Клиническая фармакология: курс на эффективную и безопасную лекарственную терапию
- Резюме
- Для цитирования
- Авторы
- Полный текст
- Литература
Среди достижений медицины последнего времени большое значение имеют исследования и данные о молекулярных и генетических механизмах, лежащих в основе патогенеза ряда заболеваний, и создание на этой базе современных лекарственных средств (ЛС), отличающихся не только терапевтическими возможностями, но и качественно лучшей переносимостью. Указанные достижения в первую очередь затронули область клинической фармакологии и рациональной фармакотерапии. В ХХI век медицина вступила с мощным арсеналом ЛС. Мировая фармацевтическая промышленность производит в настоящее время десятки тысяч их наименований.
Проблема лекарственного обеспечения, рациональной и безопасной фармакотерапии в настоящее время стала одной из наиболее актуальных в деятельности практикующих врачей, в том числе клинических фармакологов лечебно-профилактических учреждений. Это связано, с одной стороны, с постоянно увеличивающимся рынком ЛС и объемом научной информации, посвященной проблемам фармакотерапии, с другой — с необходимостью определять наиболее востребованные группы и классы ЛС с учетом финансирования лечебных учреждений [1, 6, 7].
В условиях существующих ресурсов здравоохранения рациональное использование ЛС является первоочередной задачей. Для этого необходимо внедрение наиболее оптимальных, научно обоснованных подходов, помогающих с наибольшей пользой и наименьшими затратами проводить рациональную, эффективную и безопасную фармакотерапию. В свою очередь, применение научно обоснованных подходов, внедрение методов «медицины, основанной на доказательствах», проведение фармакоэкономического анализа требует специальных знаний и навыков.
Ключевые слова: безопасная терапия, вначале о главном, генетический полиморфизм, клиническая фармакология, лекарственные средства, фармакотерапия
Для цитирования: Кукес В.Г., Журавлёва М.В., Сычёв Д.А. Клиническая фармакология: курс на эффективную и безопасную лекарственную терапию // Вестник терапевта. 2018. № 12 (36).
Кукес Владимир Григорьевич — д. м. н., профессор, академик РАН, заведующий кафедрой клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО «Первый Московский государственный медицинский университет им. И. М. Сеченова» Минздрава России. 119991, г. Москва, ул. Б. Пироговская, д. 2, стр. 4. E-mail: doctor.ru@rusmg.ru
Журавлёва Марина Владимировна — д. м. н., профессор кафедры клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО «Первый Московский государственный медицинский университет им. И. М. Сеченова» Минздрава России. 119991, г. Москва, ул. Б. Пироговская, д. 2, стр. 4. E-mail: mvzhuravleva@mail.ru
Сычёв Дмитрий Алексеевич — д. м. н., профессор, заведующий кафедрой клинической фармакологии и терапии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России. 123995, г. Москва, ул. Баррикадная, д. 2/1. E-mail: dmitry.alex.sychev@gmail.com
Клиническая фармакология как отдельная область медицины существует более 40 лет. За этот период развились различные аспекты лекарственной терапии, включая методологию клинических исследований и исследований метаболизма ЛС (начало 60-х гг. ХХ века), фармакоэкономику (конец 90-х гг.). До середины 90-х гг. клиническая фармакология существовала в основном как научно-прикладное направление. В 1997 г. Приказом МЗ РФ № 131 в лечебно-профилактические учреждения России была введена новая специальность — «врач-клинический фармаколог» [4], а в 2010 г. вышел Приказ МЗСР РФ № 1022н «Об утверждении порядка оказания медицинской помощи населению по профилю “клиническая фармакология”» [2, 3, 6, 7]. Это было обусловлено необходимостью решения проблемы эффективной и безопасной фармакотерапии, оптимизации использования средств, контроля и коррекции побочного действия ЛС.
В начале XXI века многие врачи возлагали большие надежды на новые группы лекарств. Несмотря на то что применение ЛС основывается на принципах доказательной медицины, по данным ВОЗ, средняя эффективность фармакотерапии составляет 60% [10]. Кроме того, растет частота нежелательных лекарственных реакций (НЛР) вплоть до смертельных исходов [8]. Следует отметить, что в отечественной и зарубежной литературе [2, 5, 11] установлено, что при назначении стандартной дозы многих ЛС, регламентированной инструкцией, у некоторых больных их концентрация в крови была высокой и развивались НЛР, у других концентрация была низкой и лечение оказывалось неэффективным [8].
НЛР остаются важнейшей проблемой фармакотерапии. Проблема безопасности проводимой лекарственной терапии предполагает сбор сведений об их возникновении. Информацию обо всех случаях побочного действия ЛС используют для более глубокого изучения причин возникновения тяжелых лекарственных осложнений и мер по их профилактике. Однако в последние годы, наряду с улучшением работы по своевременному извещению о выявленных случаях НЛР, оставался нерешенным вопрос о создании условий для более полного учета всех этих реакций. Этому должно помочь участие и организация данной работы врачами-клиническими фармакологами.
В соответствии с положением Порядка, пациента на консультацию к клиническому фармакологу направляет лечащий врач (врач-специалист, врач-терапевт участковый, врач-педиатр участковый, врач общей практики — семейный врач) в случаях:
— неэффективности проводимой фармакотерапии;
— при назначении ЛС с низким терапевтическим индексом;
— выявления серьезных и непредвиденных НЛР;
при необходимости назначения ЛС с ожидаемым риском развития серьезных НЛР, в том числе при беременности и в период кормления грудью.
Наиболее сложным является проведение рациональной фармакотерапии в условиях коморбидной и полиморбидной патологии, полипрагмазии, геронтофармакологии.
Необходимость дополнительного изучения особенностей фармакокинетики и фармакодинамики ЛС определяет направление на консультацию к врачу-клиническому фармакологу также в следующих клинических случаях:
— при назначении комбинаций ЛС, увеличивающих частоту НЛР;
— при одномоментном назначении больному 5 и более наименований ЛС или свыше 10 наименований при курсовом лечении (полипрагмазии);
— при назначении антибактериальных препаратов резерва, в том числе при неэффективности ранее проводимой антибактериальной терапии; при нарушении функции почек или печени и других состояниях, изменяющих фармакокинетику ЛС, и при подозрении на наличие и/или выявление фармакогенетических особенностей пациента.
Важнейшее значение имеет развитие клинической фармакогенетики — раздела клинической фармакологии и клинической генетики, изучающего место и роль генетических факторов в формировании ответа организма человека на прием ЛС: эффективность, неэффективность, развитие НЛР [1]. Известно, что центральное место в биотрансформации ЛС занимает система цитохрома Р-450, о которой известно следующее (рис. 1) [6]:
— более 40% ЛС, зарегистрированных в РФ, метаболизируются с участием изоферментов CYP450;
— 8% ЛС — пролекарства, а лекарствами являются их активные метаболиты;
— входят в класс гемопротеинов, относятся к цитохромам типа b;
— у человека выявлено 57 генов и более 59 псевдогенов системы цитохрома P450;
— изоферменты цитохрома Р-450 объединены в 18 семейств и 43 подсемейства.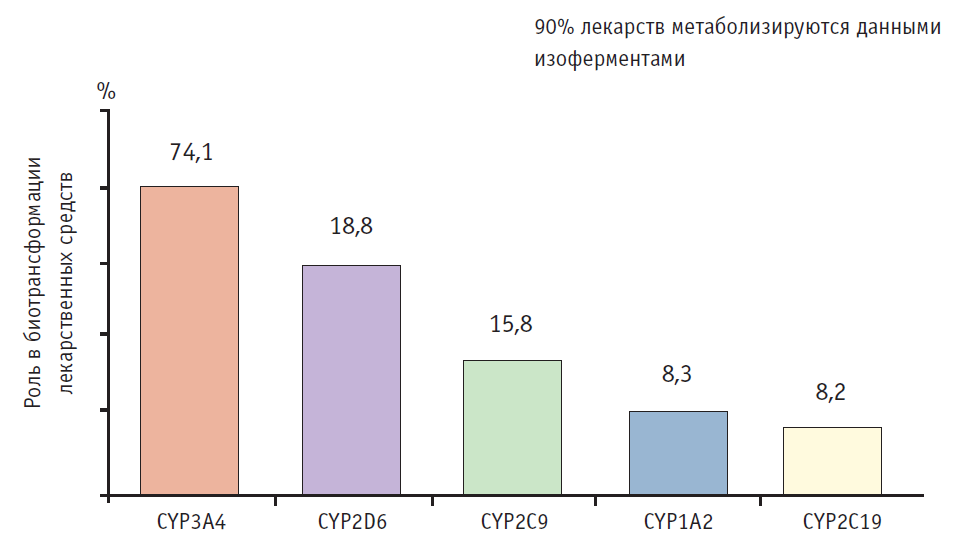

Рис. 1. Вклад различных изоферментов цитохрома Р-450 в биотрансформацию лекарственных средств [1]
На активность изоферментов цитохрома Р-450 влияют следующие факторы, определяющие индивидуальный фармакологический ответ [1]:
— генетический полиморфизм;
— сопутствующие заболевания (печени, почек, кишечника, сердечно-сосудистой и респираторной систем);
— совместное применение ингибиторов/индукторов ЛС;
— характер пищевого рациона, компоненты которого могут быть ингибиторами/индукторами ферментов (например, некоторые фруктовые соки).
Хотя роль наследственности в формировании индивидуального ответа на ЛС известна давно, понимание механизмов, связывающих генетические особенности пациента с изменением эффективности и безопасности фармакотерапии, пришло лишь с развитием соответствующих методов молекулярной биологии и реализацией международной программы «Геном человека». Закономерности, выявляемые фармакогенетикой, позволяют врачу индивидуально подходить к выбору как самих ЛС, так и их доз для каждого конкретного пациента, обеспечивая максимально эффективную и безопасную фармакотерапию [2].
В настоящее время активно изучают роль генов, контролирующих синтез и работу ферментов биотрансформации ЛС, в частности изоферментов цитохрома Р-450, ферментов II фазы биотрансформации (N-ацетилтрансферазы, глутатион-S-трансферазы) и транспортеров ЛС (Р-гликопротеин, транспортеры органических анионов и катионов) [7]. Результаты фармакогенетического теста представляют собой идентифицированные генотипы больного по тому или иному полиморфному маркеру. Как правило, клинический фармаколог или медицинский генетик интерпретирует результаты фармакогенетического теста — формулирует рекомендации по выбору ЛС и его дозировки для конкретного пациента. Применение таких тестов позволяет заранее прогнозировать фармакологический ответ на ЛС, персонализировано подойти к его выбору и режиму дозирования, а иногда и определять тактику ведения пациентов. Для фармакогенетического тестирования перспективно использование технологий, основанных на «микрочипах» (microarray-technology, ДНК-чипы). Фармакогенетическое тестирование можно рассматривать как один из прикладных инструментов персонализированной медицины [9].
Интерпретацию результатов фармакогенетического тестирования проводят в том числе с применением инструкций по медицинскому применению ЛС (российских, Food and Drug Administration, European Medicines Agency), рекомендаций международных и национальных профессиональных научных общественных организаций. При этом рекомендуемые в соответствии с алгоритмами режимы дозирования регламентированы в инструкциях по медицинскому применению и типовых клинико-фармакологических статьях Государственного реестра ЛС.
В настоящее время активно изучают фармакогенетическое тестирование большого числа разных классов ЛС, в том числе при проведении терапии антикоагулянтами и антиагрегантами (варфарин, клопидогрел и др.), гиполипидемической терапии статинами (симвастатин, аторвастатин и др.), антиаритмической терапии (бета-адреноблокаторы, пропафенон и др.), психотропной терапии антидепрессантами (амитриптилин, венфлаксин, сертралин и др.), противосудорожной терапии (карбамазепин, фенитоин), противоопухолевой фармакотерапии (тамоксифен, иринотекан, азатиоприн,), терапии с применением моноклональных антител к рецептору EFGR (цетуксимаб, панитумумаб, трастузумаб и др.), противоопухолевой таргетной терапии с применением селективных ингибиторов тирозинкиназы EGFR (гефитиниб, эрлотиниб), противогрибковой и противовирусной терапии, особенно у пациентов с факторами риска.
Важное методологическое направление — терапевтический лекарственный мониторинг (ТЛМ). В таблице приведены примеры ЛС, для которых показан метод ТЛМ. Однако для большого количества классов и групп ЛС продолжается изучение особенностей проведения и прикладное значение ТЛМ, в частности для классов антибиотических ЛС (аминогликозиды, изониазид, рифабутин, стрептомицин и др.).
Таблица. Препараты, подлежащие терапевтическому лекарственному мониторингу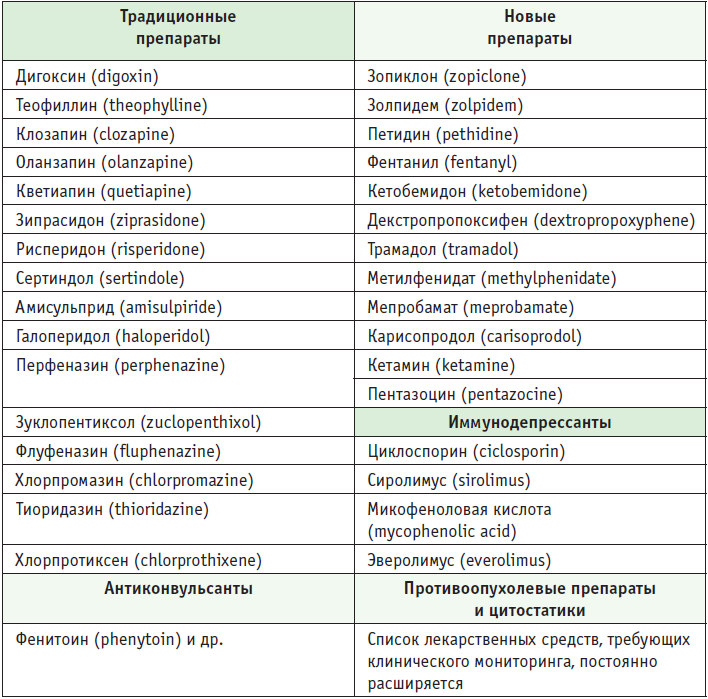

При проведении фармакотерапии особое внимание необходимо уделять тем ЛС, которые имеют активные метаболиты, образующиеся в процессе биотрансформации. Существуют ЛС, изначально неактивные, и лишь в результате биотрансформации из них образуются активные метаболиты, определяющие фармакодинамические эффекты (рис. 2) [9].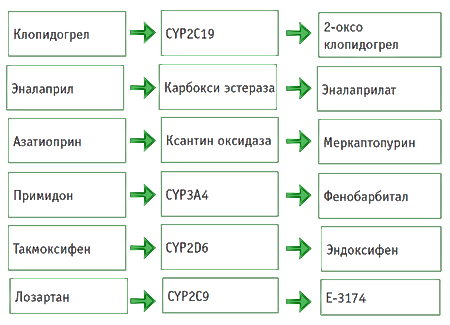

Рис. 2. Примеры пролекарств, активные метаболиты которых образуются с участием ферментов биотрансформации [9]
Генетические факторы могут также существенно влиять на процессы биотрансформации ЛС. Эти факторы представляют собой полиморфизмы в генах изоферментов цитохрома Р-450, причем их частота может значительно варьировать в различных этнических группах и популяциях, определяя этническую чувствительность к ЛС. Так, у 800 москвичей мы изучили частоты «медленных» аллелей генов изоферментов цитохрома Р-450, наиболее значимых для биотрансформации ЛС (рис. 3) [5, 10]. Эти частоты были сопоставимы с частотами в других европейских группах, при этом следует обратить внимание, что все носители «медленных» аллелей являются группами риска развития НЛР при применении ЛС-субстратов данных изоферментов цитохрома Р-450.
Проблема НЛР в клинической практике была актуальна всегда. Так, еще немецкий философ E. C. Lambert в XIX веке писал: «Есть больные, которым нельзя помочь, но нет таких больных, которым нельзя не навредить».
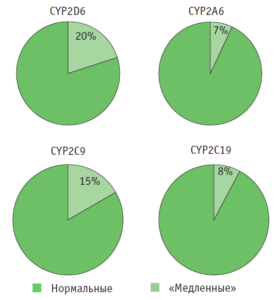
Рис. 3. Распределение носителей «медленных» аллелей изоферментов цитохрома Р-450 [5]
Развитие клинической фармакологии необходимо связывать с дальнейшим развитием методологии персонализированной медицины [2, 11], которая позволяет индивидуализировать выбор ЛС, режимов дозирования с учетом особенностей пациента, состояния его метаболизма и транспортных систем путем создания методик определения активности изоферментов цитохрома Р-450 и транспортеров ЛС [7, 12].
Очевидно, что внедрение этих методик в клиническую практику потребует выстраивания целой системы, которая могла бы быть реализована в так называемых Центрах персонализированной медицины, работающих на практическое здравоохранение по различным клиническим направлениям.
Данные центры, к которым могут быть прикреплены определенные регионы, должны сочетать методологии доказательной и персонализированной медицины, что расширяет возможности врача по обеспечению максимально эффективного и безопасного лечения. При этом следует помнить, что технологии персонализированной медицины не противоречат необходимости внедрения стандартов, напротив, оценка активности изоферментов Р-450 позволит врачу выбрать ЛС и их режим дозирования для конкретного пациента в рамках стандарта. Таким образом, чтобы ЛС применяли правильно с позиций персонализированной медицины, необходимо разработать доступные методы оценки активности изоферментов цитохрома Р-450.
Заключение
Сегодня у клинической фармакологии большое будущее. Вопросы рациональной, а значит, эффективной, качественной и безопасной фармакотерапии далеко вышли за рамки медицинского сообщества, они справедливо относятся к важнейшим стратегическим задачам сегодняшнего дня. Поэтому развитие нормативной базы по специальности «клиническая фармакология», привлечение высококвалифицированных специалистов, процессы интеграции, внедрение научных достижений и возможностей и принципов персонализированной медицины — это основа и залог проведения рациональной фармакотерапии в сфере обращения лекарственных средств.
Подготовлено по материалам научно-практического медицинского рецензируемого журнала «Доктор.Ру» № 3(7), 2014
1. Кукес В. Г., Грачёв С. В., Сычёв Д. А., Раменская Г. В. Метаболизм лекарственных средств: научные основы персонализированной медицины. М.: ГЭОТАР-Медиа, 2008. 304 с.
2. Кукес В. Г., Сычёв Д. А. Персонализированная медицина: новые возможности для повышения безопасности фармакотерапии // Ремедиум. 2010. № 1. С. 38–40.
3. Приказ Министерства здравоохранения и социального развития Российской Федерации от 22 ноября 2010 г. № 1022н «Об утверждении Порядка оказания медицинской помощи населению по профилю “Клиническая фармакология”». URL: https://www.rg.ru/2010/12/31/farmakologia-dok.html (дата обращения — 15.12.2013).
4. Приказ Министерства здравоохранения Российской Федерации от 05 мая 1997 г. № 131 «О введении специальности “клиническая фармакология”» URL: https://www.med-pravo.ru/PRICMZ/PricMZ1997/Pric131-1997.htm (дата обращения — 15.12.2013).
5. Сычёв Д. А., Раменская Г. В., Игнатьев И. В., Кукес В. Г. Клиническая фармакогенетика / Под редакцией В. Г. Кукеса, Н. П. Бочкова. М.: ГЭОТАР-Медиа, 2007. 248 с.
6. Федеральный закон от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» (в ред. Федеральных законов от 27.07.2010 № 192-ФЗ, от 11.10.2010 № 271-ФЗ, от 29.11.2010 № 313-ФЗ, от 06.12.2011 № 409-ФЗ). https://base.consultant.ru/cons/cgi/online.cgi?req=doc;base=LAW;n=160120 (дата обращения — 15.12.2013).
7. Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». URL: https://www.rg.ru/2011/11/23/zdorovie-dok.html (дата обращения — 15.12.2013).
8. Cohen N. Pharmacogenomics and personalized medicine. N. J.: Humana Press, 2010. 528 p.
9. Conner K. P., Woods C. M., Atkins W. M. Interactions of cytochrome P450s with their ligands // Arch Biochem Biophys. 2011. Vol. 507. N 1. P. 56–65.
10. Frew A. General principles of investigating and managing drug allergy // Br. J. Clin. Pharmacol. 2011. Vol. 71. N 5. P. 642–646.
11. Huttunen K. M., Mähönen N., Raunio H., Rautio J. Cytochrome P450-activated prodrugs: targeted drug delivery // Curr. Med. Chem. 2008. Vol. 15. N 23. P. 2346–2365.
12. Yanai H., Hanauer S. B. Assessing response and loss of response to biological therapies in IBD // Am. J. Gastroenterol. 2011. Vol. 106. N 4. P. 685–698.
Следующая статья
Лекарства, помимо полезного влияния на организм человека, могут оказывать и неблагоприятное. Такое н...